La Electrólisis De Una Disolución Acuosa De Cloruro De Sodio (NaCl): Producción De Cloro, Hidrógeno E Hidróxido De Sodio.
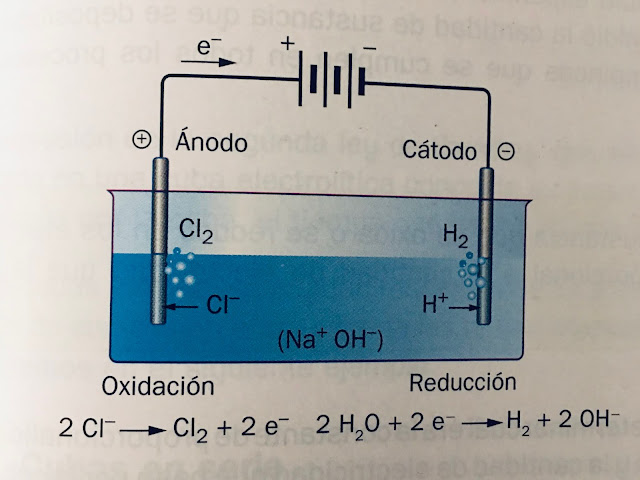
Si la electrólisis de sal común o Cloruro de sodio (NaCl) no se hace fundida sino en disolución acuosa, no se obtiene cloro y sodio, como podría suponerse, sino cloro e hidrógeno.
La interpretación de este fenómeno hay que buscarla en el valor de los potenciales de reducción de agua y catión Na+.
En una electrólisis los cationes se dirigen al CÁTODO y allí se reducen (disminuyen su número de oxidación o valencia). En la disolución hay dos posibles especies que se pueden reducir: el catión sodio y el agua.
Las dos especies compiten para realizar la REDUCCIÓN, pero lo hará aquella que cuyo potencial de reducción sea MAYOR. Esa es el agua pues su potencial de reducción es menos negativo y, por tanto, mayor.
El proceso global que tiene lugar en la cuba electrolítica es:
 |
Con lo cual, se generan hidrógeno y cloro gaseosos que se desprenden en forma de burbujas. Al añadir cloruro de sodio y no participar los iones Na+ en la reacción redox (son iones espectadores), quedaría NaOH disociado en sus iones.
El proceso global es:
Este proceso REDOX es de gran interés industrial pues, aparte de obtener hidrógeno y cloro gaseosos, se obtiene hidróxido de sodio (NaOH) que permanece disuelto.
Este razonamiento sobre la competencia entre cationes para efectuar la REDUCCIÓN en una electrólisis se hace extensivo a cualquier catión metálico.
Los metales cuyos potenciales de reducción sean inferiores a -0,83 V no pueden obtenerse NUNCA por electrólisis de una disolución acuosa de sus sales.
En la siguiente figura se muestra una escala de potenciales de reducción estándar para varios iones metálicos indicando si pueden obtenerse por electrólisis de una disolución acuosa de sus sales:
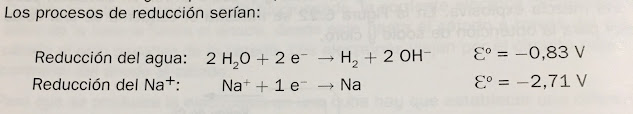


NOMBRE DEL LIBRO POR FISSSSSS
ResponderEliminarNo tengo libro, sólo publico aquí.
EliminarQuimica 2 Bachillerato, cap 7
Eliminar